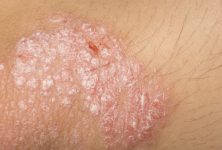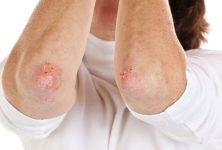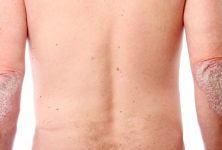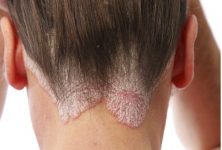
La fuerte asociación entre las mutaciones de pérdida de función en el gen de barrera cutánea que codifica la filagrina y el riesgo de dermatitis atópica ha centrado la atención en el papel importante de la disfunción de la barrera epitelial en esta enfermedad cutánea.
Se ha hallado que los pacientes con mutaciones de la filagrina presentan piel seca, inicio temprano de dermatitis atópica que es más persistente y por lo general asociado con asma, alergia alimentaria e infección microbiana. Estudios recientes sugieren que la estratificación de los pacientes con versus sin mutaciones de la filagrina identifica pacientes con diferentes vías mecanicistas de inflamación.
Los pacientes con mutaciones de pérdida de función de filagrina están asociados con la expresión aumentada de las citoquinas IL-1 en su capa córnea y respuesta al estrés mediada por interferón tipo 1. Se ha informado que los niños con dermatitis atópica con genes de filagrina normales presentan desregulación de los procesos metabólicos lipídicos. También se ha hallado que la secreción dependiente de filagrina de esfingomielinasa protege contra la muerte de queratinocitos inducida por la toxina alfa estafilocócica. Esto sugiere firmemente que los pacientes con mutaciones de filagrina son un endotipo distinto de dermatitis atópica con efectos mecanicistas diferentes, los que se pueden emplear para identificar un subgrupo de dermatitis atópica, especialmente para el desarrollo de nuevos tratamientos dirigidos a la función de la barrera cutánea.
La importancia de finalmente definir endotipos en la dermatitis atópica es que estos nuevos subtipos se puedan usar en el diseño de estudios clínicos y en el desarrollo de fármacos para dirigir los tratamientos a pacientes más propensos a beneficiarse de un tratamiento basado en el mecanismo. En el futuro, la dermatitis atópica se podría estratificar por genotipo y biomarcadores que reflejen la polarización inmune para complementar su fenotipo clínico.
Los pacientes con dermatitis atópica con mutaciones homocigotas nulas de filagrina o heterocigotos compuestos, comparados con los pacientes con expresión génica normal de filagrina, tienen inicio temprano de la enfermedad cutánea, eczema más persistente y grave. Por lo general tienen hiperlinearidad palmar, mayor riesgo de sensibilización a alergenos e historial de alergia alimentaria y asma. También, tiene pH incrementado en su capa cornea, lo que podría predisponerlos a la colonización por S. aureus. Los pacientes que tienen mutaciones heterocigotas de filagrina tienen un fenotipo intermedio y pueden superar la dermatitis atópica en la adolescencia mientras los homocigotos o heterocigotos compuestos pueden padecer la enfermedad de por vida. Estos pacientes podrían también servir como un objetivo para el tratamiento de la filagrina.
También se ha demostrado que la actividad de la dermatitis atópica (cuantificada mediante SCORAD) se correlaciona positivamente con la expresión de la piel lesional y no lesional de los mediadores Th2 y Th22 (es decir, IL-13, IL-22), y negativamente con la expresión de los marcadores de diferenciación terminal. Aunque la activación inmune es significativamente superior en la piel lesional en comparación con la no lesional, reducciones impresionantes en la expresión de una amplia variedad de genes de diferenciación epidérmica (es decir, loricrina, periplaquina e involucrina, además de filagrina) caracterizan la piel lesional y no lesional de la dermatitis atópica. Como se ha demostrado que la citoquinas Th2 (IL-4/IL-13) y Th22 (IL-22) inhiben la expresión de los productos de diferenciación terminal, en los queratinocitos, el mayor nivel circulante de estas citoquinas puede provocar esta supresión global de las proteínas de barrera así como también los incrementos en S100As detectados en el inicio de las lesiones agudas.
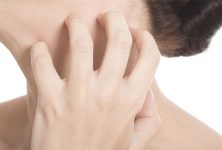
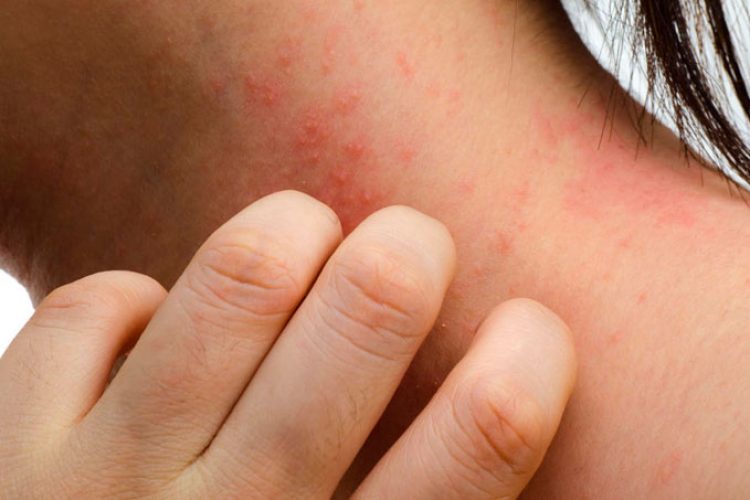
El prurito crónico definido por picor persistente que dura más de 6 semanas se considera la característica clínica dominante de la dermatitis atópica, lo que representa una carga importante para los pacientes que la padecen. Por lo tanto la comprensión de los mecanismos subyacentes del prurito crónico en los pacientes con dermatitis atópica es de gran importancia, no solamente para comprender el curso de la enfermedad sino también para desarrollar nuevas estrategias terapéuticas con el fin de proporcionar alivio para este síntoma clínico dominante. El prurito crónico en pacientes con dermatitis atópica parece ser independiente de los efectos de la histamina mediados a través de los receptores de la histamina 1; el papel de los receptores de la histamina 4 sobre el prurito en la dermatitis se está debatiendo actualmente.
La señal para prurito se transmite mediante las fibras nerviosas cutáneas ubicadas dentro de la dermis y la epidermis muy cerca de las células residentes, como fibroblastos, queratinocitos, mastocitos, y células de Langerhans. Estas fibras nerviosas cutáneas forman redes neuronales tipo varicosas en su parte terminal, lo que permite la transmisión no sináptica de los neurotransmisores y neuropéptidos. Los pacientes con dermatitis atópica pueden tener alteraciones en las fibras nerviosas en la piel. Varios mediadores inducen prurito no histaminérgico mediante receptores, como el receptor de potencial transitorio A1, receptores activados por proteinasas 2 y 4, entre otros. Los mediadores del prurito pueden derivar de fuentes endógenas y exógenas. S aureus y HDM, 2 desencadenantes de la exacerbación de la dermatitis atópica, son capaces de inducir prurito mediante las proteasas. TSLP y IL-31 son mediadores endógenos para la inducción de prurito crónico en pacientes con dermatitis atópica. Las células epiteliales son la mayor fuente de TSLP en la piel, y la expresión de queratinocitos en la piel con dermatitis atópica está muy aumentada. TSLP induce picor directamente mediante la activación de neuronas sensoriales cutáneas por medio de la activación de TRPA1. IL-31 es producido principalmente por las células TH2 y señales a través del receptor IL-31, el que se expresa en los queratinocitos y fibras nerviosas cutáneas.
Una explicación para el mayor riesgo de alergias posteriores ante la función defectuosa de la barrera de la piel en la dermatitis atópica es que la sensibilización a alergenos podría ocurrir mediante la barrera cutánea defectuosa, lo que inicia la marcha atópica. Se ha propuesto que la penetración de alergenos puede conducir a la sensibilización transcutánea. Algunos estudios longitudinales clave han destacado que la sensibilización IgE a alergenos medioambientales en el eczema es un factor importante en la progresión al asma. En el grupo placebo de un estudio controlado y aleatorizado de niños con síntomas de dermatitis atópica y antecedentes familiares de alergia halló un riesgo significativamente mayor de desarrollar asma en aquellos sensibilizados en el basal a huevo (RR, 1.4; IC del 95%, 1.1–1.7), ácaros intradomiciliarios (RR 1.6; IC del 95% 1.3–1.9), o polen de pasto (RR 1.7; IC del 95%, 1.4–2.1). En estudios de cohortes, la presencia de sensibilización temprana a alimentos en niños con eczema temprano aumentó el riesgo de asma posterior. Estos hallazgos sugieren que la dermatitis atópica asociada a la IgE es un paso inicial más preciso de la marcha atópica.
Los defectos en la función de la barrera cutánea también están asociados con respuestas sistémicas como aumento de la IgE total e hiperreactividad de las vías aéreas, posiblemente debido a la posterior sensibilización. En niños, la dermatitis atópica parece estar asociada con la inflamación de las vías aéreas incluso en ausencia de asma. La sensibilización cutánea precede a la sensibilización de las vías aéreas al mismo alergeno y es uno de los predictores más fuertes para el desarrollo del asma infantil y la rinitis alérgica. Estos hallazgos conjuntamente sugieren que las intervenciones para mejorar la función de la barrera, lo que potencialmente minimizaría la penetración de alergenos, podría ser una medida importante para controlar el inicio de la marcha atópica.
A pesar de que ha habido mucho interés en la barrera cutánea defectuosa como el vínculo entre la dermatitis atópica y las alergias posteriores, algunos estudios sugieren que la TSLP también podría vincular la dermatitis atópica y al asma. Las lesiones cutáneas crónicas en la dermatitis atópica expresan TSLP, una citoquina tipo interleuquina 7 liberada debido a traumatismo, varios microbios e inflamación, lo que a su vez inicia o exacerba la inflamación alérgica. Estudios en humanos han demostrado que la sobreexpresión de TSLP en la piel está asociada con la dermatitis atópica y no atópica. Modelos de ratones han demostrado que un aumento significativo de TSLP sérica desencadena hiperrespuesta bronquial a alergenos inhalados en ausencia de sensibilización a alergenos epicutáneos. Estos hallazgos sugieren que el vínculo entre la sobreexpresión de TSLP en la piel con dermatitis atópica y otros trastornos alérgicos podría ser independiente del defecto de la barrera cutánea.
Esta nota es un resumen de la presentación realizada por el Dr. Bradley Chipps, del Capital Allergy & Respiratory Disease Center, Sacramento, California, Estados Unidos, en la Reunión Anual de la Academia Americana de Dermatología (AAD) de 2017, que se celebró entre los días 3 y 7 de Marzo en Orlando, Florida, Estados Unidos.