Desde hace varios años se sabe que la patofisiología de la diabetes mellitus tipo 2 (DMT2) se caracteriza por una deficiencia en la masa de células beta del páncreas y en la secreción de insulina1,2.
En los individuos obesos sin diabetes existe 50% más de masa de células beta del páncreas que en los sujetos delgados sin diabetes. Mientras que en los pacientes con DMT2 la masa es de aproximadamente la mitad que la de los delgados sin diabetes.
En relación con la secreción de insulina, frente a valores de glucemia de 144 mg/dl los pacientes con DMT2 tienen una marcada disminución en la secreción de insulina con respecto a la de sujetos sin diabetes1,2.
En relación con la secreción endógena de insulina está establecido que: i) la secreción es bifásica; ii) no es constante, sino que se produce por pulsos [cada 4-6 minutos]; iii) que la circulación portal es especialmente importante.
Estas son las características que habría que reproducir con una administración exógena de insulina. En el cuadro 1 se plantea una hipótesis en relación con la evolución de la masa de células beta con la edad.
En pacientes sin diabetes la masa de células puede ser grande, mediana o baja (tal como en las curvas 1, 2 y 3 del cuadro 1), sin ser diabéticos. Con la edad y la exposición a situaciones, tales como resistencia a la insulina y obesidad, habrá una disminución de esa masa y, dependiendo de la condición inicial (determinada por la genética del individuo), atravesará o no el umbral de la diabetes.
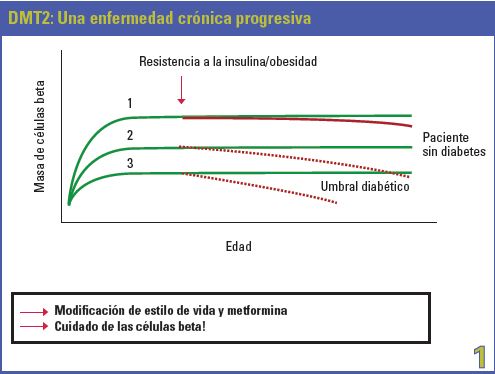
La progresión de la enfermedad podrá atenuarse por cambios en el estilo de vida y tratamiento con metformina destinado a proteger las células beta.
En la historia de los tratamientos antidiabéticos se encuentran: insulina (en 1921), metforminas y sulfonilureas (en los 50), acarbosa (en 1990), glitazonas (en 2000), GLP-1 (en 2007) y SGLT-2 (en 2012).
En muchos casos existen discusiones sobre los efectos adversos de las distintas drogas, pero se cuenta con muchos fármacos para el tratamiento.
En relación al momento de iniciar el tratamiento con insulina se ha estudiado la evolución de la mortalidad de los pacientes con DMT2 sometidos a tratamiento intensivo, o menos intensivo, con insulina.
Los resultados de un estudio después de 10 años de seguimiento mostraron que hubo una reducción de mortalidad entre 1997 y 2007 con un tratamiento más intensivo3.
En términos de los valores para el control de la HbA1C y de la glucemia en ayuno las recomendaciones son muy diversas en los distintos países y las diferentes asociaciones.
Los valores de la HbA1C<7.0% son recomendados por la mayoría de las asociaciones, excepto por la AACE (American Association of Clinical Endocrinologist) que propone que sea individualizado para cada paciente y de la DDG (German Diabetes Society) que indica valores de 6.5%-7.5%.
En el caso de la glucemia en ayuno la situación es más compleja porque hay situaciones, como la de la ADA (American Diabetes Association), que aconseja un rango muy amplio de 70-130 mg/dl, o menos amplio, tal como la DDG (German Diabetes Society) que aconseja 100-125 mg/dl.
Otras asociaciones sugieren valores menores a un límite, como la AACE (American Association of Clinical Endocrinologists) que recomiendan <110 mg/dl, la EASD (European Association for the Study of Diabetes) y la ESC (European Society of Cardiology) que recomiendan <120 mg/dl y, finalmente, los que dan un valor único, tal como la IDF (International Diabetes Federation) que indica 115 mg/dl.
Por lo tanto, la conclusión es que la diabetes mellitus es una enfermedad heterogénea que requiere objetivos individualizados de tratamiento.
El rol de la glucosa al estimular la liberación de insulina de las células beta del páncreas ha sido ampliamente demostrado en células aisladas4.
Los estudios cuantitativos en células de islotes humanos mostraron que existió una curva dosis-respuesta entre los niveles de glucosa y la secreción de insulina 5, donde el 50% de la máxima estimulación de la secreción de insulina correspondió a una concentración de glucosa de 130-140 mg/dl, lo que coincidió con lo indicado en las recomendaciones.
En los estudios fisiológicos en pacientes se ha observado que la curva bifásica de liberación de insulina fue muy variable frente a un incremento en los valores de la glucemia6.
Se ha estudiado la replicación de las células beta del páncreas humano a lo largo del tratamiento con insulina durante períodos prolongados (hasta 15 años), y se encontró una correlación positiva entre el tiempo de duración del tratamiento con insulina y la mayor replicación de las células beta, así como el mayor tamaño del islote7, indicando que la insulina, por si misma ejerció un efecto positivo sobre el crecimiento de dicha población celular.
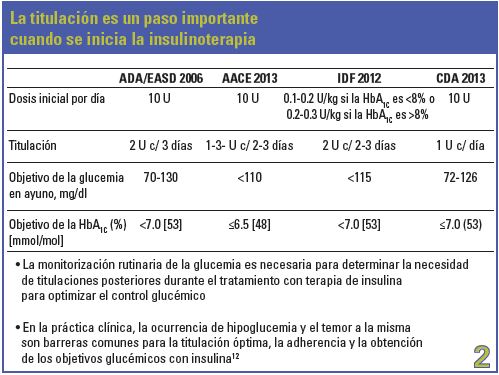
Cuando se inicia el tratamiento, la titulación de las drogas es un aspecto relevante. Se debe destacar que no todas las drogas pueden ser tituladas, por ejemplo, no se puede titular la metformina.También es difícil de hacerlo con las sulfonilureas.
Básicamente, la insulina es la única que puede ser titulada. El cuadro 2 indica los aspectos más importantes a tener en cuenta según ADA/EASD 20068, AACE 20139, IDF 201210 y CDA (Canadian Diabetes Association) 201311. Otro aspecto a considerar es la participación del paciente en la titulación.
Se ha demostrado que los resultados son variables, dependiendo del objetivo analizado, cuando se compara si la titulación estuvo guiada por el profesional o por el paciente.
En los niveles de la HbA1C se encontró una mejoría significativamente mayor cuando la titulación fue guiada por el propio paciente13. En cambio, no hubo diferencias en la aparición de la frecuencia de las hipoglucemias.
En la búsqueda de optimizar la titulación de insulina se realizó un análisis agrupado de estudios prospectivos.
Se compararon pacientes que nunca habían recibido insulina vs. pacientes que habían recibido glargina-100 con una dosis de inicio de 10 UI agregada a la terapia con antidiabéticos orales.
Se compararon tres algoritmos para la titulación de la insulina:
• Uno: Una UI de incremento una vez al día, si la glucemia en ayuno es mayor al objetivo.
• Dos: 2 UI de incremento cada 3 días si la glucemia en ayuno supera el objetivo.
• Tres: 2-8 UI de incremento semanal basado en el promedio de 2 días en los niveles de glucemia en ayuno con un objetivo ≤100 mg/dl.
Analizando los resultados se observó que no hubo diferencias significativas en el control de la glucemia aplicando los distintos algoritmos; pero sí hubo diferencias en la frecuencia de aparición de hipoglucemias, que fue mayor para el algoritmo nº 2 que para los otros dos14.
Resulta importante estudiar las nuevas insulinas, que producen curvas de glucemia más planas y extendidas15-19.
Comparando la insulina degludec con glargina-100 se encontró que tuvieron similares efectos mejorando la HbA1C y los cambios en el peso 20,21. También se encontró menor frecuencia de episodios de hipoglucemia, particularmente nocturnos, con degludec respecto a glargina- 10020.
Finalmente, se encontró que la reducción de las hipoglucemias fue más pronunciada en el período de mantenimiento20.
Es importante resaltar el Programa EDITION, que se encuentra en proceso, que analiza los resultados del tratamiento con glargina-300 vs. glargina-100 a través de todo el espectro de tratamiento de pacientes con DMT2:
• EDITION 1: (N=807) Previo: insulina basal + horarios de comida y dosaje de insulina basal ≥42 UI/día.
• EDITION 2: (N=811) Previo: insulina basal ≥42 UI/día) + terapias orales.
• EDITION JP 3: (N=241) Previo: insulina basal + terapias orales, pacientes japoneses.
• EDITION 3: (N= 878) Previo: terapias orales solamente, pacientes vírgenes de insulina.
Los estudios del programa son aleatorizados 1:1, abiertos, en grupos paralelos, multinacionales y todos fueron construidos con un diseño similar, donde se suministró la insulina (Gla-300 o Gla-100), junto con antidiabéticos orales a lo largo de 6 meses.
El objetivo primario de valoración en todos los estudios fue determinar la no-inferioridad de Gla-100 en la reducción de la HbA1C. Se trabajó con un comité de supervisión de la titulación en el lugar y los investigadores tuvieron la posibilidad de realizar los ajustes necesarios para mantener la seguridad del paciente.
En cuanto a los resultados, no hubo diferencias en el control glucémico entre Gla-300 y Gla-100 en todos los estudios del programa EDITION22-25, ni en la glucemia en ayuno26. Se encontró que Gla-300 mostró menor frecuencia de hipoglucemias con respecto a Gla-10026.
Adicionalmente, hubo una pequeña diferencia en ganancia de peso entre ambos tratamientos. Gla-300 produjo
menor ganancia de peso 26.
Conclusiones
• La DMT2 es una enfermedad heterogénea caracterizada por la pérdida progresiva de células beta.
• Para evitar una estimulación crónica o una situación de estrés para las células beta la glucosa debe ser mantenida por debajo de 110-120 mg/dl (objetivo de glucemia fisiológica).
• Debido a su curso progresivo la DMT2 frecuentemente requiere tratamiento de intensificación o titulación de las terapias existentes.
• La terapia con insulina basal provee control de glucosa y retiene la salud de las células beta.
Desarrollo de nuevas insulinas basales de acción prolongada
• Glargina-300: – reducciones de HbA1C similares a las de glargina- 100 después de 6 meses: – metaanálisis de EDITION 1-2-3: menor riesgo de hipoglucemia, menor ganancia de peso, similar eficacia y seguridad que con glargina-100.
• La insulina basal titulada puede ser usada en un amplio rango de perfil de pacientes.
Referencias
1 Butler AE, Janson J, Bonner-Weir S, Ritzel R, Rizza RA, Butler PC. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes. Diabetes 2003 Jan;52(1):102-10.
2 Laedtke T, Kjems L, Pørksen N, Schmitz O, Veldhuis J, Kao PC, Butler PC. Overnight inhibition of insulin secretion restores pulsatility and proinsulin/insulin ratio in type 2 diabetes. Am J Physiol Endocrinol Metab 2000 Sep;279(3):E520-8.
3 Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HA. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008 Oct 9;359(15):1577-89.
4 Michael DJ, Ritzel RA, Haataja L, Chow RH. Pancreatic beta-cells secrete insulin in fast- and slow-release forms.
Diabetes 2006 Mar;55(3):600-7.
5 Ritzel RA, Veldhuis JD, Butler PC. Glucose stimulates pulsatile insulin secretion from human pancreatic islets by increasing secretory burst mass: dose-response relationships. J Clin Endocrinol Metab 2003 Feb;88(2):742-7.
6 Relationships between fasting plasma glucose levels and insulin secretion during intravenous glucose tolerance tests. Brunzell JD, Robertson RP, Lerner RL, Hazzard WR, Ensinck JW, Bierman EL, Porte D Jr. J Clin Endocrinol Metab 1976 Feb;42(2):222-9.
7 Schott J. Diabetes 60 (Supple 1) A531, 2011.
8 Nathan DM, Buse JB, Davidson MB, Heine RJ, Holman RR, Sherwin R, Zinman B. Management of hyperglycemia
in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy: a consensus statement from
the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2006
Aug;29(8):1963-72.No abstract available. Erratum in: Diabetes Care 2006 Nov;49(11):2816-8.
9 Garber AJ, Abrahamson MJ, Barzilay JI, Blonde L, Bloomgarden ZT, Bush MA, Dagogo-Jack S, Davidson MB, Einhorn D, Garvey WT, Grunberger G, Handelsman Y, Hirsch IB, Jellinger PS, McGill JB, Mechanick JI, Rosenblit PD, Umpierrez G, Davidson MH; American Association of Clinical Endocrinologists. AACE comprehensive diabetes management algorithm 2013. Endocr Pract 2013 Mar-Apr;19(2):327-36.
10 IDF. Global Guidelines for Type 2 diabetes. Http://www.idf.org/global-guideline-type-2-diabetes-2012
11 2013 CDA Clinical Practice Guidelines. Http://guidelines.diabetes.ca
12 Ahrén B. Avoiding hypoglycemia: a key to success for glucose-lowering therapy in type 2 diabetes. Vasc Health Risk Manag 2013;9:155-63.
13 Improvement of glycemic control in subjects with poorly controlled type 2 diabetes: comparison of two treatment
algorithms using insulin glargine. Davies M, Storms F, Shutler S, Bianchi-Biscay M, Gomis R; ATLANTUS Study Group. Diabetes Care. 2005 Jun;28(6):1282-8.
14 Dailey G, Aurand L, Stewart J, Ameer B, Zhou R. Comparison of three algorithms for initiation and titration of insulin glargine in insulin-naive patients with type 2 diabetes mellitus. J Diabetes 2014 Mar;6(2):176-83.
15 Heise T, Nosek L, Bøttcher SG, Hastrup H, Haahr H. Ultra-long-acting insulin degludec has a flat and stable glucoselowering effect in type 2 diabetes. Diabetes Obes Metab 2012 Oct;14(10):944-50.
16 Heise T, Bott S, Rave K, Dressler A, Rosskamp R, Heinemann L. No evidence for accumulation of insulin glargine
(LANTUS): a multiple injection study in patients with Type 1 diabetes. Diabet Med 2002 Jun;19(6):490-5.
17 Jonassen I, Havelund S, Hoeg-Jensen T, Steensgaard DB, Wahlund PO, Ribel U. Design of the novel protraction mechanism of insulin degludec, an ultra-long-acting basal insulin. Pharm Res 2012 Aug;29(8):2104-14.
18 Sinha VP, Howey DC, Choi SL, Mace KF, Heise T. Steady-state pharmacokinetics and glucodynamics of the novel, long-acting basal insulin LY2605541 dosed once-daily in patients with type 2 diabetes mellitus. Diabetes Obes Metab 2014 Apr;16(4):344-50.
19 Jax T, et al. New insulin glargine formulation has a flat and prolonged steady state profile in subjects with type 1 diabetes. Diabetologia 2013;56 (Suppl 1):A1029. See more at: http://www.epresspack.net/sanofi-at-easd/sanofi-to-presentnew- clinical-data-at-the-50th-easd-meeting/#sthash.gFWQk4Vp.dpuf
20 Ratner RE, Gough SC, Mathieu C, Del Prato S, Bode B, Mersebach H, Endahl L, Zinman B. Hypoglycaemia risk with insulin degludec compared with insulin glargine in type 2 and type 1 diabetes: a pre-planned meta-analysis of phase 3 trials. Diabetes Obes Metab 2013 Feb;15(2):175-84.
21 Garber AJ, King AB, Del Prato S, Sreenan S, Balci MK, Muñoz-Torres M, Rosenstock J, Endahl LA, Francisco AM,
Hollander P; NN1250-3582 (BEGIN BB T2D) Trial Investigators. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 2 diabetes (BEGIN Basal-Bolus Type 2): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. Lancet 2012 Apr 21;379(9825):1498-507.
22 Riddle MC, Bolli GB, Ziemen M, Muehlen-Bartmer I, Bizet F, Home PD; EDITION 1 Study Investigators. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using basal and mealtime insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 1). Diabetes Care 2014 Oct;37(10):2755-62.
23 Yki-Järvinen H, Bergenstal R, Ziemen M, Wardecki M, Muehlen-Bartmer I, Boelle E, Riddle MC; EDITION 2 Study Investigators. New Insulin Glargine 300 Units/mL Versus Glargine 100 Units/mL in People With Type 2 Diabetes Using Oral Agents and Basal Insulin: Glucose Control and Hypoglycemia in a 6-Month Randomized Controlled Trial (EDITION 2). Diabetes Care 2014 Dec;37(12):3235-43.
24 Bolli GB, Diabetes 2014, Suppl 1, A19.
25 Terauchi Y, Masayoxhi K, Cheng X, Shimizu S, Hirose T, on behalf of the EDITION JP 2 Study group. Glycemic Control and Hypoglycemia in Japanese People with T2DMReceiving New Insulin Glargine 300 U/mL in Combination with OADs (EDITIONJP 2). Diabetes 2014, suppl 1A. 94-LB.
26 Ritzel R, Roussel R, Bolli GB, Vinet L, Yky-Jarvinen H. New Insulin Glargine 300 U/mL: Glycemic Control and Hypoglycemia in a Meta-analysis of Phase 3a EDITION Clinical Trials in People with T2DM. Diabetes Care 2014 63 (supple 1A) L890.