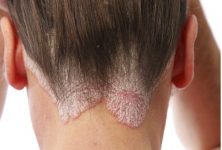
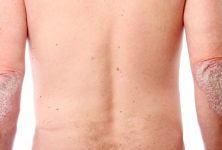
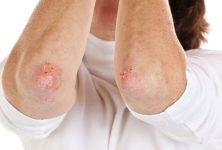
En el marco del Congreso Americano de Dermatología 2018, la doctora Amy S. Paller, Chair, Department of Dermatology, Northwestern University Skin Disease Research Center (SDRC), Chicago, Illinois, Estados Unidos, presentó este trabajo relacionado con la dermatitis atópica, una enfermedad cutánea crónica basada en la disfunción de la barrera de la piel, la que conjuntamente con factores medioambientales y diversos cambios del sistema inmune provoca lesiones eccematosas y pruriginosas en los pliegues de flexión y en otras zonas características. Las exacerbaciones agudas así como también las lesiones eccematosas en la piel seca acompañadas por prurito intenso caracterizan el curso de la enfermedad.1 Aunque el panorama clínico descrito es bastante homogéneo, los factores desencadenantes de la enfermedad son variados y la red fisiopatológica involucrada es bastante compleja.1
En la fase aguda de la dermatitis atópica, una gran cantidad de alergenos a través de la barrera de la piel deteriorada estimulan a los mastocitos para que se degranulen y liberen mediadores inflamatorios como histamina, PGD2, IL-6, IL- y TNF-a así como también IL-31. Las células epiteliales dañadas de la piel liberan TSLP la que aumenta aún más la inflamación cutánea tipo Th2. En respuesta a la invasión de alergenos y antígenos, las células de Langerhans y queratinocitos residentes en la piel liberan citocinas inflamatorias que incluyen IL-12 e IL-18 así como también quimiocinas para captar otros tipos de células inmunes, como Mɸs, basófilos, eosinófilos y neutrófilos, así como también células T. Aunque las respuestas Th1, Th2, Th17 y Th22 coexisten en la piel con dermatitis atópica aguda, las respuestas tipo Th2 participan principalmente con la patogénesis de la dermatitis atópica aguda al mediar la inflamación cutánea tipo 2. Las respuestas Th1, Th2, Th17 y Th22 están involucradas en la patogénesis de la dermatitis atópica crónica. La citocinas proinflamatorias como IL-12 e IL-18 secretadas por las células dendríticas de la piel respaldan la activación de Th1. El IFN-c secretado por las células Th1 inducen la apoptosis de queratinocitos, mientras que la activación de las células Th22 inducen el remodelamiento y grosor de la piel con dermatitis atópica crónica.1
Datos clínicos en pacientes con asma alérgica (identificada por biomarcadores) han respaldado los roles importantes de tres citocinas tipo 2 en particular: IL‑5, IL‑4 e IL‑13, las que comparten un receptor en común. IL‑4 e IL‑13 son mediadores potentes de la inmunidad tipo 2 con funciones tanto superpuestas como diferentes relacionadas con sus patrones de expresión de los receptores. Aunque IL‑4 e IL‑13 solamente comparten un 25% de homología de aminoácidos, estas citocinas comparten una porción en común del receptor, IL‑4Rα, que conjuntamente con diferentes cadenas complementarias inducen la señalización.2
Avances recientes en el conocimiento de la patogénesis subyacente y los factores de riesgo de la dermatitis atópica han generado dos teorías opuestas que intentan explicar el inicio y la historia natural de la enfermedad: las hipótesis fuera-dentro y la dentro-fuera. La hipótesis fuera-dentro propone que las variaciones genéticas dentro de la población da como resultado una subpoblación de individuos que albergan defectos en la función de barrera de la piel. Una alteración de la barrera permite que alergenos y microbios crucen el epitelio, lo que a su vez desencadena una reacción inflamatoria. Alternativamente, la hipótesis dentro-fuera propone que defectos subyacentes ocurren a nivel del sistema inmune. Una respuesta inmune polarizada en pacientes con dermatitis atópica provoca la sensibilización de la inmunoglobulina E (IgE) a los patógenos y contaminantes cutáneos. La respuesta inmune resultante induce la inflamación local y la ruptura de la barrera de la piel.3
El gen más replicado y significativo que afecta a la dermatitis atópica es la filagrina. Las mutaciones de pérdida de función de la filagrina ocurren en el 10% de los europeos, lo que aporta un incremento del riesgo de dermatitis atópica, alergia alimentaria y asma. Las mutaciones en la filagrina aumentan el riesgo de desarrollar asma solamente ante la presencia de dermatitis atópica.4 La capa córnea contribuye considerablemente con la función de la barrera de la piel. La pérdida de agua transepidérmica es una medición in vivo no invasiva de la pérdida de agua en la capa córnea. La disfunción de la barrera de la piel medida mediante la pérdida de agua transepidérmica a los 2 días y a los 2 meses después del nacimiento precede y predice la dermatitis atópica a 1 año.4
Una revisión sistemática y metaanálisis demostraron que los pacientes con dermatitis atópica tienen colonización de S. aureus más frecuente que los controles sanos y que la colonización aumenta ante una enfermedad más severa.5
Otro estudio halló que las estructuras y la diversidad de la comunidad bacteriana cambiaron en el transcurso del tiempo, lo que sugirió que la edad afectó en gran medida el microbioma de la piel en los niños. A diferencia de la dermatitis atópica establecida, estos pacientes con dermatitis atópica infantil no tenían comunidades disbióticas perceptibles antes o con la enfermedad y no estaban colonizados por S aureus. Al comparar a los pacientes y a los sujetos control, los niños que con piel afectada a los 12 meses tuvieron diferencias estadísticamente significativas en las comunidades bacterianas en la fosa antecubital a los 2 meses comparado con los niños no afectados en el mes 12. En particular, los estafilococos comensales eran significativamente menos abundantes en los niños afectados a los 12 meses, lo que sugiere que este género podría proporcionar protección contra el desarrollo tardío de dermatitis atópica. Este estudio sugirió que los niños de 12 meses de edad con dermatitis atópica no tenían colonización de S aureus antes de padecer dermatitis atópica.6
Referencias
1. Peng W, Novak N. Pathogenesis of atopic dermatitis. Clin Exp Allergy. 2015 Mar;45(3):566-74.
2. Gandhi NA, Bennett BL, Graham NM, et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016 Jan;15(1):35-50.
3. Blakely K, Gooderham M, Papp K. Dupilumab, A Monoclonal Antibody for Atopic Dermatitis: A Review of Current Literature. Skin Therapy Lett. 2016 Mar;21(2):1-5.
4. Kelleher M, Dunn-Galvin A, Hourihane JO, et al. Skin barrier dysfunction measured by transepidermal water loss at 2 days and 2 months predates and predicts atopic dermatitis at 1 year. J Allergy Clin Immunol. 2015 Apr;135(4):930-5.
5. Totté JE, van der Feltz WT, Hennekam M, et al. Prevalence and odds of Staphylococcus aureus carriage in atopic dermatitis: a systematic review and meta-analysis. Br J Dermatol. 2016 Oct;175(4):687-95.
6. Kennedy EA, Connolly J, Hourihane JO, et al. Skin microbiome before development of atopic dermatitis: Early colonization with commensal staphylococci at 2 months is associated with a lower risk of atopic dermatitis at 1 year. J Allergy Clin Immunol. 2017 Jan;139(1):166-172.
76th AAD Annual Meeting
San Diego, Estados Unidos
20 de febrero de 2018