La EPOC es una enfermedad común, prevenible y tratable caracterizada por síntomas respiratorios persistentes y limitación del flujo aéreo usualmente debidos a alteraciones de la vía aérea y/o alveolares causados por lo general por una exposición significativa a partículas o gases nocivos.
La limitación crónica del flujo aéreo característica de la EPOC es causada por una combinación
de enfermedades de la vías aéreas pequeñas (p. ej. bronquiolitis obstructiva) y destrucción del
parénquima (enfisema), lo que varía de persona a persona.
La inflamación crónica provoca cambios estructurales, estrechamiento de las vías aéreas pequeñas y destrucción del parénquima pulmonar.
Además de la limitación en el flujo aéreo, la nueva definición de EPOC indica que los pacientes podrían presentar cambios alveolares que sugieren la presencia de enfisema. Esto es importante puesto que en el desarrollo de la EPOC tanto la bronquiolitis como el enfisema se desarrollan en paralelo, pudiendo predominar un aspecto sobre el otro.
La EPOC es la causa principal de morbilidad y mortalidad en todo el mundo que ocasiona una carga económica y social considerable y creciente.1,2
La EPOC es el resultado de una interacción compleja de exposición prolongada acumulada de gases y partículas tóxicas, combinada con una variedad de factores del huésped que incluyen genética, hiperrespuesta de las vías aéreas y desarrollo pulmonar deficiente durante la niñez.3-5
DIAGNÓSTICO Y EVALUACIÓN INICIAL DE LA EPOC
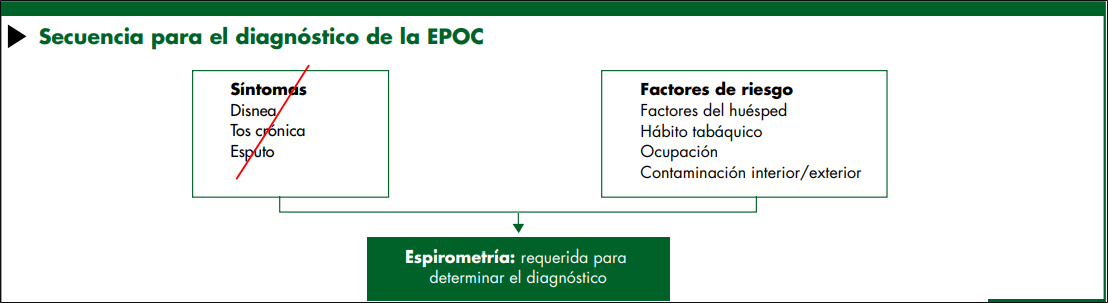
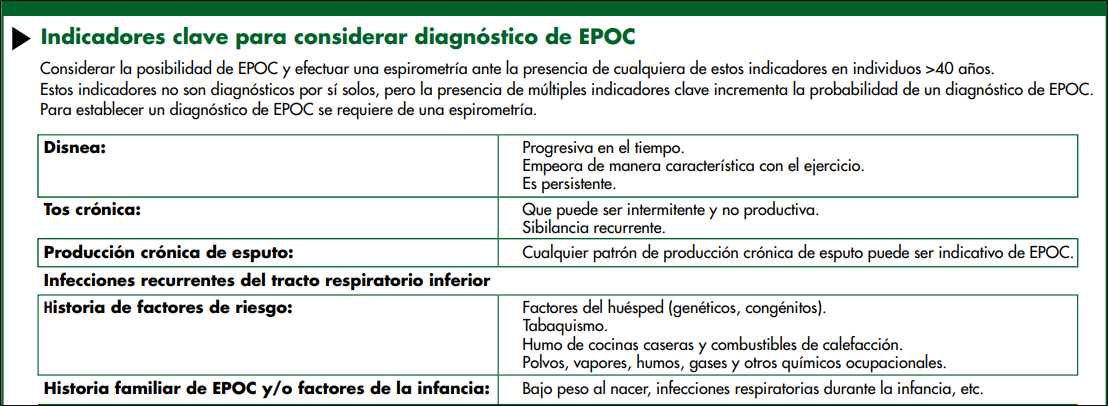
Debería considerarse EPOC en cualquier paciente con disnea, tos crónica o producción de esputo, e historia de exposición a factores de riesgo de la enfermedad
Se requiere la espirometría para realizar el diagnóstico de EPOC en este contexto clínico;23 la presencia de un VEF1/CVF<0.70 posbroncodilatador confirma la existencia de una limitación persistente de flujo aéreo y por lo tanto de EPOC en pacientes con síntomas correspondientes y exposiciones significativas a estímulos nocivos.
HERRAMIENTA DE EVALUACIÓN ABCD
La comprensión del impacto de la EPOC en un paciente individual combina la evaluación sintomática con la clasificación espirométrica o el riesgo de exacerbaciones. En las guías GOLD 2017 se ha mejorado la herramienta ABCD a fin de separar los grados espirométricos de los grupos ABCD.
Los pacientes deberán someterse a espirometría para determinar la gravedad de la limitación del flujo aéreo, deberán ser evaluados para disnea (empleando la escala modificada de disnea mMRC, por sus siglas en inglés: modified Medical Research Council) o síntomas (cuestionario de evaluación CAT, COPD Assessment Test) y se deberá registrar la historia de exacerbaciones (incluyendo hospitalizaciones previas).
El número proporciona información con respecto a la severidad de la limitación del flujo aéreo (grado espirométrico 1 a 4) y la letra (grupos A-D), sobre la carga de los síntomas y el riesgo de exacerbación que se pueden usar para guiar el tratamiento. La separación de la limitación del flujo aéreo de los parámetros clínicos favorece la determinación de lo que se está evaluando y clasificando. Esto facilitará recomendaciones terapéuticas más precisas en base a parámetros que están generando los síntomas del paciente en un momento dado.
EVALUACIÓN
Los objetivos de la evaluación de la EPOC son determinar el nivel de limitación del flujo aéreo, su impacto sobre el estado de salud del paciente y el riesgo de eventos futuros como exacerbaciones, admisiones hospitalarias o muerte para finalmente, guiar el tratamiento.
Para lograr estos objetivos, la evaluación de la EPOC debe considerar los siguientes aspectos de la enfermedad en forma separada: presencia y severidad de anomalías espirométricas; naturaleza y magnitud actual de los síntomas del paciente; antecedentes de exacerbaciones y riesgo futuro; y presencia de comorbilidades.
Las exacerbaciones de EPOC se definen como un empeoramiento agudo de los síntomas respiratorios que dan lugar a tratamiento adicional.24-27 Estos eventos se clasifican como leves, moderados o severos.
Los pacientes con EPOC por lo general padecen importantes enfermedades crónicas concomitantes al momento del diagnóstico y la EPOC representa un componente importante del desarrollo de multimorbilidades especialmente en los adultos mayores en respuesta a factores de riesgo comunes (p. ej., envejecimiento, hábito tabáquico, alcohol, dieta e inactividad).28,29-31
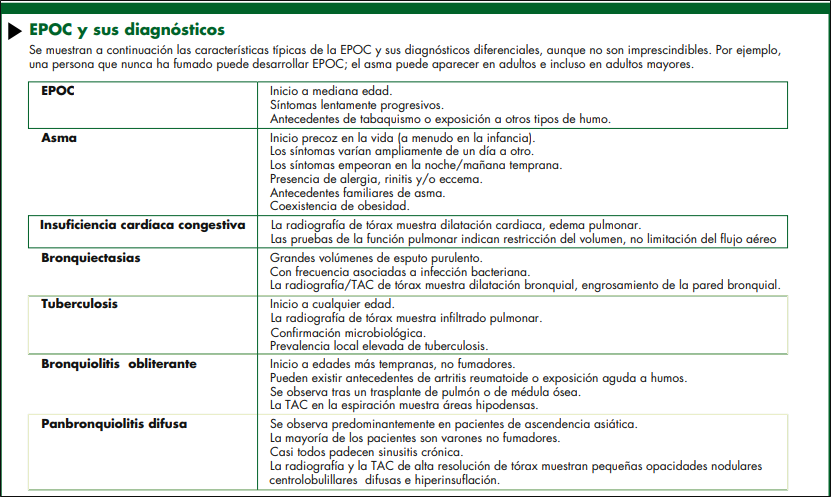
DIAGNÓSTICO DIFERENCIAL DE LA EPOC
REFERENCIAS
1. Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups
in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380(9859):
2095-128.
2. Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and
injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012; 380(9859):
2163-96.
3. Lange P, Celli B, Agusti A, et al. Lung-Function Trajectories Leading to Chronic Obstructive Pulmonary Disease. NEngl J Med 2015; 373(2): 111-22.
4. Stern DA, Morgan WJ, Wright AL, Guerra S, Martinez FD. Poor airway function in early infancy and lung function
by age 22 years: a non-selective longitudinal cohort study. Lancet 2007; 370(9589): 758-64.
5. Tashkin DP, Altose MD, Bleecker ER, et al. The lung health study: airway responsiveness to inhaled methacholine in smokers with mild to moderate airflow limitation. The Lung Health Study Research Group. Am Rev Respir Dis 1992; 145(2 Pt 1): 301-10.
6. Miravitlles M, Worth H, Soler Cataluna JJ, et al. Observational study to characterise 24-hour COPD symptoms and their relationship with patient-reported outcomes: results from the ASSESS study. Respir Res 2014; 15: 122.
7. Allinson JP, Hardy R, Donaldson GC, Shaheen SO, Kuh D, Wedzicha JA. The Presence of Chronic Mucus
Hypersecretion across Adult Life in Relation to Chronic Obstructive Pulmonary Disease Development. Am J Respir Crit Care Med 2016; 193(6): 662-72.
8. Montes de Oca M, Perez-Padilla R, Talamo C, et al. Acute bronchodilator responsiveness in subjects with and without airflow obstruction in five Latin American cities: the PLATINO study. Pulm Pharmacol Ther 2010; 23(1): 29-35.
9. von Haehling S, Anker SD. Cachexia as a major underestimated and unmet medical need: facts and numbers.
Journal of cachexia, sarcopenia and muscle 2010; 1(1): 1-5.
10. Schols AM, Soeters PB, Dingemans AM, Mostert R, Frantzen PJ, Wouters EF. Prevalence and characteristics of nutritional depletion in patients with stable COPD eligible for pulmonary rehabilitation. Am Rev Respir Dis 1993; 147(5):1151-6.
11. Rutten EP, Calverley PM, Casaburi R, et al. Changes in body composition in patients with chronic obstructive pulmonary disease: do they influence patient-related outcomes? Annals of nutrition & metabolism 2013; 63(3): 239-47.
12. Schols AM, Broekhuizen R, Weling-Scheepers CA, Wouters EF. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clin Nutr 2005; 82(1): 53-9.
13. US Preventive Services Task Force (USPSTF), Siu AL, Bibbins-Domingo K, Grossman DC, Davidson KW, Epling JW Jr, et al. Screening for Chronic Obstructive Pulmonary Disease: US Preventive Services Task Force Recommendation Statement. JAMA. 2016 Apr 5;315(13):1372-7.
14. American Lung Association Epidemiology and Statistics Unit. http://www.lung.org/assets/dociments/research/
copd-trend-report.pdf.
15. Regan EA, Lynch DA, Curran-Everett D, Curtis JL, Austin JH, Grenier PA, et al. Clinical and Radiologic Disease in Smokers With Normal Spirometry. JAMA Intern Med. 2015 Sep;175(9):1539-49.
16. Lamprecht B, McBurnie MA, Vollmer WM, et al. COPD in never smokers: results from the population-based burden of obstructive lung disease study. Chest 2011;139(4): 752-63.
17. Yin P, Jiang CQ, Cheng KK, et al. Passive smoking exposure and risk of COPD among adults in China: the
Guangzhou Biobank Cohort Study. Lancet 2007; 370(9589): 751-7.
18. Mercado N, Ito K, Barnes PJ. Accelerated ageing of the lung in COPD: new concepts. Thorax 2015;70(5): 482-9.
19. Lawlor DA, Ebrahim S, Davey Smith G. Association of birth weight with adult lung function: findings from the British Women’s Heart and Health Study and a meta-analysis. Thorax 2005; 60(10): 851-8.
20. Gershon AS, Warner L, Cascagnette P, Victor JC, To T. Lifetime risk of developing chronic obstructive pulmonary disease: a longitudinal population study. Lancet 2011; 378(9795): 991-6.
21. Silva GE, Sherrill DL, Guerra S, Barbee RA. Asthma as a risk factor for COPD in a longitudinal study. Chest 2004; 126(1): 59-65.
22. de Marco R, Accordini S, Marcon A, et al. Risk factors for chronic obstructive pulmonary disease in a European
cohort of young adults. Am J Respir Crit Care Med 2011; 183(7): 891-7.
23. Buist AS, McBurnie MA, Vollmer WM, et al. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet 2007; 370(9589): 741-50.
24. Hurst JR, Wedzicha JA. What is (and what is not) a COPD exacerbation: thoughts from the new GOLD guidelines. Thorax 2007; 62(3): 198-9.
25. Wedzicha JA, Seemungal TA. COPD exacerbations: defining their cause and prevention. Lancet 2007; 370(9589): 786-96.
26. Seemungal TA, Donaldson GC, Paul EA, Bestall JC, Jeffries DJ, Wedzicha JA. Effect of exacerbation on quality of
life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998; 157(5 Pt 1): 1418-22.
27. Burge S, Wedzicha JA. COPD exacerbations: definitions and classifications. Eur Respir J Suppl 2003; 41: 46s-53s.
28. Soler-Cataluna JJ, Martinez-Garcia MA, Roman Sanchez P, Salcedo E, Navarro M, Ochando R. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax 2005; 60(11): 925-31.
29. Soriano JB, Visick GT, Muellerova H, Payvandi N, Hansell AL. Patterns of comorbidities in newly diagnosed COPD and asthma in primary care. Chest 2005; 128(4): 2099-107.
30. National Institute for Health and Care Excellence. Multimorbidity: clinical assessment and management, in press. 2016. https://www.nice.org.uk/guidance/indevelopment/gid-cgwave0704/documents (accessed 1 August 2016).
31. Vanfleteren LE, Spruit MA, Groenen M, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 187(7): 728-35.